 Nanoaditivum Envirox™ je vytvořeno z nanočástic oxidu céru (CeO2). Cér se s úspěchem využívá jako katalyzátor v mnoha jiných průmyslových odvětvích, včetně petrochemie při rafinaci ropy nebo moderně v třícestných katalyzátorech vozidel. Jde totiž o oxid vysoce stabilní, netoxický a odolný. Oxid céru působí jako určitá zásobárna kyslíku, který dokáže postupně do procesu spalování uvolňovat, čímž oxiduje kysličník uhelnatý a další uhlovodíkové zplodiny. Kyslík zpětně absorbuje ze vznikajících oxidů dusíku, které redukuje na dusík. Ten je v porovnání se svými oxidy pro životní prostředí neškodný. Výsledkem použití takového aditiva je pak delší a kvalitnější prohoření paliva a tím i čistší spalování (nižší obsah emisí ve výfukových plynech). A také ekologičtější provoz.
Nanoaditivum Envirox™ je vytvořeno z nanočástic oxidu céru (CeO2). Cér se s úspěchem využívá jako katalyzátor v mnoha jiných průmyslových odvětvích, včetně petrochemie při rafinaci ropy nebo moderně v třícestných katalyzátorech vozidel. Jde totiž o oxid vysoce stabilní, netoxický a odolný. Oxid céru působí jako určitá zásobárna kyslíku, který dokáže postupně do procesu spalování uvolňovat, čímž oxiduje kysličník uhelnatý a další uhlovodíkové zplodiny. Kyslík zpětně absorbuje ze vznikajících oxidů dusíku, které redukuje na dusík. Ten je v porovnání se svými oxidy pro životní prostředí neškodný. Výsledkem použití takového aditiva je pak delší a kvalitnější prohoření paliva a tím i čistší spalování (nižší obsah emisí ve výfukových plynech). A také ekologičtější provoz.
Jak to vlastně technicky funguje?
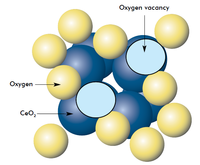 Účinnost oxidu céru, jako katalyzátoru, souvisí s jeho schopností podstoupit transformaci ze stechiometrického CeO2 (+4) stavu k Ce2O3 (+3) při relativně (přinejmenším ve srovnání s dalšími kysličníky) nízké reakční energií. To je v relaci s obecnými vlastnostmi fluoritové kysličníkové struktury odchylovat se silně ze stechiometrie. Dokonce i při velké ztrátě kyslíku z krystalické mřížky a tudíž vytvořením velkého počtu kyslíkových vakancí, zůstává zachovaná fluoritická struktura. Tyto suboxidy se mohou pohotově reoxidovat na CeO2 v oxidačním prostředí.
Účinnost oxidu céru, jako katalyzátoru, souvisí s jeho schopností podstoupit transformaci ze stechiometrického CeO2 (+4) stavu k Ce2O3 (+3) při relativně (přinejmenším ve srovnání s dalšími kysličníky) nízké reakční energií. To je v relaci s obecnými vlastnostmi fluoritové kysličníkové struktury odchylovat se silně ze stechiometrie. Dokonce i při velké ztrátě kyslíku z krystalické mřížky a tudíž vytvořením velkého počtu kyslíkových vakancí, zůstává zachovaná fluoritická struktura. Tyto suboxidy se mohou pohotově reoxidovat na CeO2 v oxidačním prostředí.
Protože nedochází k fázové změně krystalické struktury při dodáváni a zpětné absorpci kyslíku, je CeO2 vhodný jako akumulátor kyslíku v katalýze prostřednictvím následující reakce:
2CeO2 ← → Ce2O3 + 0.5 O2
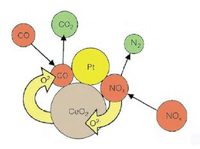
Oxid céru našel své uplatnění při katalytické konverzi výfukových plynů, kdy jsou škodlivé zplodiny hoření přeměněny na neškodné plyny při následujících reakcích:
Spalování uhlovodíků:
(2x+y)CeO2 + CxHy → [(2x+y)/2]Ce2O3 + x/2 CO2 + y/2 H2O
Hoření sazí:
4CeO2 + Csaze → 2Ce2O3 + CO2
Redukce oxidů dusíku:
Ce2O3 + NO → 2CeO2 + ½ N2
Nespálené palivo, částice a škodlivé plyny jsou tak podstatně zredukovány při využití CeO2 jako katalyzátoru.
Aby byl katalyzátor jako aditivum efektivní, musí mít tři základní vlastnosti:
1, úplně oxidovat uhlovodíky
2, neměl by preferovat oxidy dusíku
3, měl by být tepelně stabilní
Jak již bylo řečeno, schopnost CeO2 „darovat“ kyslík umožňuje kompletní shoření uhlovodíků a sazí. Prakticky je rozhodujícím faktorem aktivační energie CeO2, tj. nejnižší teplota, při které nastane uvolňování kyslíku. Ačkoliv teplota plynů v dieselových motorech je poměrně vysoká (cca. 1700°C), nízká katalytická teplota umožňuje mnohem komplexnější hoření paliva v prvních milisekundách po vzplanutí. Nižší průměrná teplota hoření, nehledě na přechodně vyšší maximální teploty, také zabraňuje produkci NOx, vzhledem k vysoké aktivační energii oxidace dusíku. Ukázalo se, že katalytická aktivita CeO2 je silně závislá na velikosti částic a specifické ploše povrchu. Aktivační teplota hoření uhlíku se redukuje z přibližně 700°C pro mikronovou velikost částic na 300°C, pokud se zvýší specifická plocha povrchu 20x. Tzv. kyslíkové vakance vznikají mnohem snadněji na povrchu CeO2 než v objemu a to vysvětluje, že materiál s vyšší specifickou plochou povrchu má vyšší katalytickou aktivitu. A to je klíčový faktor, který umožňuje katalytickým systémům na bázi céru soupeřit s kovy jako platina nebo palladium při katalýze spalování.
 Vysoká teplotní stabilita CeO2 má za následek schopnost reoxidace nanočástic Ce2O3 a to, že zůstávají aktivní po inicializaci prvotního vzplanutí. V dieselových motorech se vytváří významné množství sazí, které se usazují ve spalovacím prostoru společně s mlhou z mazacího oleje. Tyto depozita mají za následek zvýšení ztrát třením a způsobují nežádoucí změny při tepelných ztrátách na vnitřních plochách. Ačkoliv je hlava pístu a stěny spalovacího prostoru poměrně chladné v porovnání s teplotou hoření, teplota neustále osciluje mezi 200° až 500°C. To je přesně rozsah aktivačních teplot uhlíku za působení nanočástic CeO2 a tím dochází k postupné oxidaci depozit a jejich odstraňování z motoru, přičemž se zvyšuje účinnost a snižuje spotřeba paliva.
Vysoká teplotní stabilita CeO2 má za následek schopnost reoxidace nanočástic Ce2O3 a to, že zůstávají aktivní po inicializaci prvotního vzplanutí. V dieselových motorech se vytváří významné množství sazí, které se usazují ve spalovacím prostoru společně s mlhou z mazacího oleje. Tyto depozita mají za následek zvýšení ztrát třením a způsobují nežádoucí změny při tepelných ztrátách na vnitřních plochách. Ačkoliv je hlava pístu a stěny spalovacího prostoru poměrně chladné v porovnání s teplotou hoření, teplota neustále osciluje mezi 200° až 500°C. To je přesně rozsah aktivačních teplot uhlíku za působení nanočástic CeO2 a tím dochází k postupné oxidaci depozit a jejich odstraňování z motoru, přičemž se zvyšuje účinnost a snižuje spotřeba paliva.




